A液:1mol/l Hcl 48.0 ml,Tris 36.4 克 ,TEMED 0.23 ml加水**100 ml pH 8.3。 B液:丙烯酰胺 28.0克 ;甲叉双丙烯酰胺 0.735 克 加水**100 ml。 C液:过硫酸铵(用前配制)1.4 % 。 配胶:A:B:C:H2O = 1:2:0.4:4.6 配胶后立即灌好装胶的玻璃管 3、点击缓冲液配制
1、将各胶柱中酶带条数、宽度、着色深浅和移动距离填入表中。
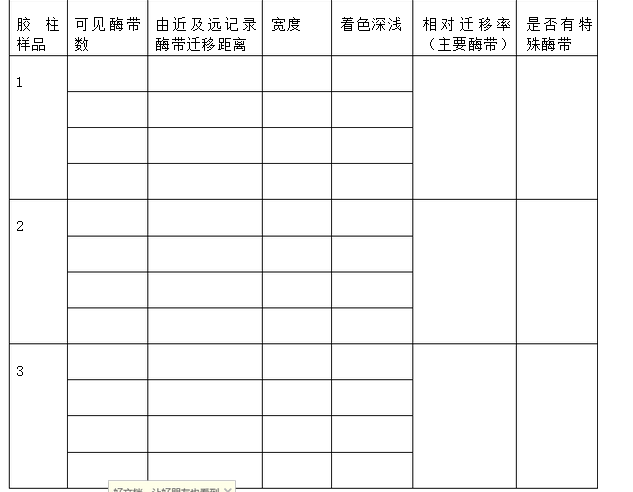
3、选择比较组分胶柱中、着色**深的酶带或特殊酶带(即该组分特有的酶带),计算酶带的相对迁移率Rf值 Rf=(某酶带迁移距离)/(溴酚蓝指示剂迁移距离) 六、
结果讨论及分析
1、配制缓冲液系统对电泳的影响:
在SDS-PAGE不连续电泳中,制胶缓冲液使用的是Tris-HCL缓冲系统,浓缩胶是PH6.7,分离胶PH8.9;而电泳缓冲液使用的Tris-甘氨酸缓冲系统。在浓缩胶中,其PH环境呈弱酸性,因此甘氨酸解离很少,其在电场的作用下,泳动效率低;而CL离子却很高,两者之间形成导电性较低的区带,蛋白分子就介于二者之间泳动。由于导电性与电场强度成反比,这一区带便形成了较高的电压梯度,压着蛋白质分子聚集到一起,浓缩为一狭窄的区带。当样品进入分离胶后,由于胶中PH的增加,呈碱性,甘氨酸大量解离,泳动速率增加,直接紧随氯离子之后,同时由于分离胶孔径的缩小,在电场作用下,蛋白分子根据其固有的带电性和分子大小进行分离。
所以,pH对整个反应体系的影响是**关重要的,实验中在排除其他因素之后仍不能很好解决问题的情况,应首要考虑该因素。 2、样品的处理: #p#分页标题#e#
根据样品分离目的不同,主要有三种处理方法:
还原SDS处理、非还原SDS处理、带有烷基化作用的还原SDS处理。 1)还原SDS处理:在上样buffer中加入SDS和DTT(或Beta巯基乙醇)后,蛋白质构象被解离,电荷被中和,形成SDS与蛋白相结合的分子,在电泳中,只根据分子量来分离。一般电泳均按这种方式处理,样品稀释适当浓度,加入上样Buffer,离心,沸水煮5min,再离心加样。
2)带有烷基化作用的还原SDS处理:碘乙酸胺的烷基化作用可以很好的并经久牢固的保护SH基团,得到较窄的谱带;另碘乙酸胺可捕集过量的DTT,而防止银染时的纹理现象。100ul样品缓冲液中10ul 20%的碘乙酸胺,并在室温保温30min。
3)非还原SDS处理:生理体液、血清、尿素等样品,一般只用1%SDS沸水中煮3min,未加还原剂,因而蛋白折叠未被破坏,不可作为测定分子量来使用。
3、SDS-PAGE电泳凝胶中各主要成分的作用。
聚丙烯酰胺的作用:丙烯酰胺与为蛋白质电泳提供载体,其凝固的好坏直接关系到电泳成功与否,与促凝剂及环境密切相关;
制胶缓冲液:浓缩胶选择pH6.7,分离胶选择pH8.9,选择tris-HCL系统,TEMED与AP:AP提供自由基,TEMED是催化剂,催化自由基引起的聚合反应进行;十二烷基磺酸钠(SDS):阴离子去污剂,作用有四:去蛋白质电荷、解离蛋白质之间的氢键、取消蛋白分子内的疏水作用、去多肽折叠。 4、提高SDS-PAGE电泳分辨率的途径.
聚丙烯酰胺的充分聚合,可提高凝胶的分辨率。建议做法:待凝胶在室温凝固后,可在室温下放置一段时间使用。忌即配即用或4度冰箱放置,前者易导致凝固不充分,后者可导致SDS结晶。一般凝胶可在室温下保存4天,SDS可水解聚丙烯酰胺。
一般常用的有氨基黑、考马斯亮蓝、银染色三种染料,不同染料又各自不同的染色方法,具体可参照郭尧君编著的《蛋白质电泳技术手册》P82-103。 5.“ 微笑”(两边翘起中间凹下)形带原因?
主要是由于凝胶的中间部分凝固不均匀所致,多出现于较厚的凝胶中。 处理办法:待其充分凝固再作后续实验。 6. “皱眉”(两边向下中间鼓起)形带原因? 主要出现在蛋白质垂直
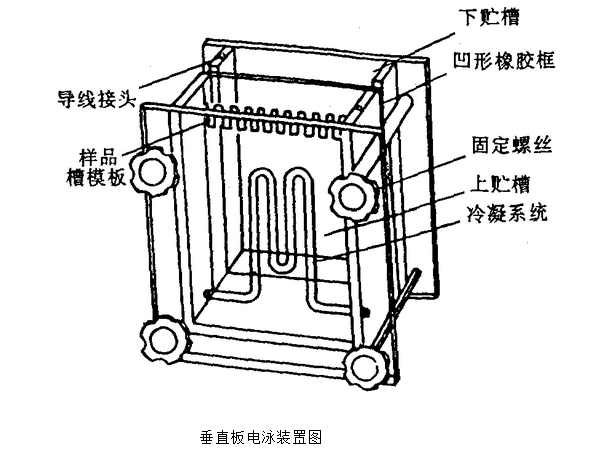
电泳槽中,一般是两板之间的底部间隙气泡未排除干净。
处理办法:可在两板间加入适量缓冲液,以排除气泡。 7.带出现拖尾现象可能原因。
主要是样品融解效果不佳或分离胶浓度过大引起的。
处理办法:加样前离心;选择适当的样品缓冲液,加适量样品促溶剂;电泳缓冲液时间过长,重新配制;降低凝胶浓度。 8. 为什么带出现纹理现象? 主要是样品不溶性颗粒引起的。
处理办法:加样前离心;加适量样品促溶剂。 9. 什么是“鬼带”,如何处理?
“鬼带”就是在跑大分子构象复杂的蛋白质分子时,常会出现在泳道顶端(有时在浓缩胶中)的一些大分子未知条带或加样孔底部有沉淀,主要由于还原剂在加热的过程中被氧化而失去活性,致使原来被解离的蛋白质分子重新折叠结合和亚基重新缔合,聚合成大分子,其分子量要比目标条带大,有时不能进入分离胶。但它却于目标条带有相同的免疫学活性,在WB反应中可见其能与目标条带对应的抗体作用。
处理办法:在加热煮沸后,再添加适量的DTT或Beta巯基乙醇,以补充不足的还原剂;或可加适量EDTA来阻止还原剂的氧化。 10. 为什么溴酚蓝不能起到指示作用? 我们在实验中常会遇到溴酚蓝已跑出板底,但蛋白质却还未跑下来的现象。主要与缓冲液和分离胶的浓度有关。
处理办法:更换正确pH值的Buffer;降低分离胶的浓度。 11. 为什么电泳的条带很粗?
电泳中条带很粗是常见的事,主要是未浓缩好的原因。
处理办法:适当增加浓缩胶的长度;保证浓缩胶贮液的pH正确(6.7);适当降低电压;
12. 为什么电泳电压很高而电流却很低呢?这种现象一般初学者易出现。比如电压50v以上,可电流却在5mA以下。主要是由于电泳槽没有正确装配,电流未形成通路。包括:a.内外槽装反;b.外槽液过少;c.电泳槽底部的绝缘体未去掉(比如倒胶用的橡胶皮)。 处理办法:电泳槽正确装配即可。
13. 浓缩胶与分离胶断裂、板间有气泡对电泳有影响吗?
这主要出现在初学者中,一般对电泳不会有太大的影响。前者主要原因是拔梳子用力不均匀或过猛所致;后者是由于在解除制胶的夹子后,板未压紧而致空气进入引起的。
14. 凝胶时间不对,或慢或快,怎么回事?
通常胶在30MIN-1H内凝。如果凝的太慢,可能是TEMED,APS剂量不够或者失效。APS应该现配现用,TEMED不稳定,易被氧化成黄色。 如果凝的太快,可能是APS和TEMED用量过多,此时胶太硬易裂,电泳时易烧胶。 15. 电泳时间比正常要长? #p#分页标题#e#
可能由于凝胶缓冲系统和电级缓冲系统地PH选择错误,即缓冲系统地PH和被分离物质的等电点差别太小,或缓冲系统的离子强度太高。 16.分离胶加上后为什么要立即加水?
加入分离胶后,立即覆一层双蒸水,一是为了使分离胶界面保持水平,用水就可以把它压平,使蛋白质分子跑时在同一水平线上;二是阻止空气中的氧气对凝胶聚合的抑制作用。