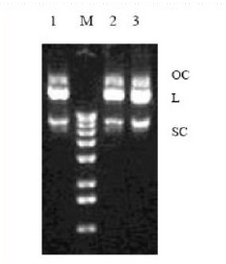

**快的是超螺旋,其次是线性DNA,**慢的是开环DNA;
其实我们提取质粒的时候常见的是两条带:超螺旋和开环DNA,但是个人觉得线性的DNA也是存在的,只是量很少而已,因为质粒如果变成线性的话,其就不能进行正常复制,就会慢慢降解掉。所以提取出来的量就会很少,但是我觉得是存在的。
用酚、氯仿法从工程菌中提取的质粒一般有三种构像,即超螺旋,线形和开环。(开环质粒是指双链环状的质粒DNA有部分解链,因此电泳速度**慢)三种构像的质粒在琼脂糖电泳的前后顺序是超螺旋>线形>开环,线形的质粒在中间,而开环的质粒在**后。
判断质粒质粒好坏的一个指标就是超螺旋质粒在所以质粒中的含量。因为用质粒转染真核细胞时,超螺旋的质粒效率**高,所以要求质粒中超螺旋质粒的含量要在90%以上,这也是对作为核酸疫苗重组质粒的要求。
根据我做实验的经验,回答你的问题
1 从细菌中大量提取的质粒电泳时,不一定均出现三条带,有时会出现两条,甚**一条(一般是超螺旋的质粒),这跟上样量也有些关系。出现不同的结果都是由抽提质粒时的操作手法造成的。如果严格按照操作步骤,超螺旋的质粒会较多。
2 酶切将质粒线性化以后,才可以用mark判断大小。如果有三种构像,可以用中间那条带与mark比较判断大小。
3 商品化的质粒我没有直接跑过电泳。我估计应该大部分是超螺旋构像。
4 酶切后线性化条带电泳时所处的位置就指示质粒的大小
首先得搞清楚,你用得内切酶在质粒序列中(包括你克隆的基因)总共有几个位点?如果2个以上,出现上述结果就比较好解释了。 可以将酶切前后得质粒一起跑电泳,比较一下,酶切后得四条带与酶切前两条带得大小是否有差异。
部分酶切也是有可能的,原因是你的质粒量太大,酶没有作用完。或者是酶活力不够/酶量太少。
质粒提取比较好的情况下,**前面得超螺旋构像较多。假如提取质粒时,加溶液II以后,剧烈地振荡,你就会发现,在质粒电泳图中,开环构像比例很高,甚**会超过超螺旋构像的亮度,也就是说这种质粒质量很差。
1,提质粒**好用kit。现在国内、国外的提质粒kit很多,质量都不错,价格也不贵。一般提取1-5ml菌体质粒的一次反应,可能就3-5元人民币,半小时时间,一台普通台式离心机(可以不带制冷的)。提取的质粒质量很好,一般都是超螺旋的,进行常规的分子生物学反应都没有问题,且很少RNA和基因组DNA污染。一句话:省时省事质好。用酚氯仿等抽,常会影响后续的操作。
2,鉴定质粒的方法。**好是测序。其次是多采用几组酶进行双酶切分析,再电泳检测片断大小与理论值是否一致。
仅仅靠电泳质粒判断大小的方法来检测误差太大。一是因为质粒结构不均一,前面很多tx都提到了。二是质粒太大后,其大小本身就不易从胶上判断准确。比如一个5kb和5.5kb的质粒其大小是不易从电泳胶上区分的。

